Tilbake til artikkelserien om metabolismen
Karbohydrater er et energigivende næringsstoff, og flere av kroppens celler er avhengig av glukose som energikilde. I artikkelen om karbohydratmetabolismen kunne du lese at vi selv kan produsere glukose for å dekke behovet, gjennom glukoneogenesen. Et annet viktig aspekt er det at vi også har egne lagre av karbohydrater, som er spesielt viktig for å regulere blodsukkeret og dermed cellenes tilgang til glukose. Disse karbohydratlagrene kalles glykogen, og finnes i leveren og skjelettmusklene.
Les mer om karbohydrater
Les om glukosemetabolismen
Glykogen
Glykogen er en lett tilgjengelig lagringsform for glukose. Et glykogenmolekyl består av lange, forgrenede kjeder av glukose, glukosylresiduer, som springer ut fra et protein som heter glykogenin. Disse glukosekjedene kan sammenlignes med stivelsesmolekylet amylopektin, og hvert glykogenmolekyl inneholder ca. 450 glukosemolekyler. Glukosemolekylene er bundet sammen med to typer glykosidbindinger, α-1,4 som binder glukosemolekyler sammen i en lang kjede og α-1,6 som lager forgreininger, noe som gjør at strukturen blir som den blir. Den ytterste enden av glukosekjeden kalles den ikke-reduserende enden, og her finner vi en fri OH-gruppe.
Forgreining av glukosekjedene er viktig for å lagre glukosemolekylene så effektivt som mulig. Strukturen gjør molekylet mer løselig, og i tillegg dannes det veldig mange ikke-reduserende ender, der enzymene som sørger for både oppbygging og nedbryting av glykogenmolekylet kan gjøre jobben sin. Forgreining muliggjør rask innlagring og utnyttelse av glukose i glykogen.
Vi finner glykogen lagret i leveren og i skjelettmusklene. Leveren kan lagre glykogen tilsvarende omtrent 10% av sin egenvekt noe som tilsvarer rundt 100-150g. Musklene kan lagre glykogen tilsvarende 1-2% av sin egenvekt. Leverglykogenet brukes for å opprettholde konsentrasjonene av glukose i blodet, mens muskelglykogenet brukes som en lokal energikilde i muskelen det er lagret i. Glykogenet lagres i cellenes cytoplasma i form av små korn, med en diameter på 10-40nm. Å lagre mange glukosemolekyler som et større makromolekyl gjør det mulig å lagre større mengder glukose uten at det blir for store endringer i det osmotiske trykket.
Glykogenmetabolismen inkluderer både syntese og nedbrytning av glykogen - prosessene som regulerer lagring og frigjøring av glukose.
Glykogensyntese
Glykogensyntesen, er prosessen der karbohydrater lagres for senere bruk. Ett og ett glukosemolekyl hektes på den ikke-reduserende enden av det voksende glykogenmolekylet, og for å hektes på må glukosemolekylet først aktiveres til UDP-glukose. UDP står for uridin difosfat, og er en uridinbase med to fosfatgrupper bundet til seg. UDP-glukose er et glukosemolekyl med UDP bundet til karbon nummer 1.
Når glukosen tas opp i cellen så vil glukosemolekylet først fosforyleres til glukose-6-fosfat (G6P), for å hindre glukosen i å fraktes ut av cellen igjen. Denne fosforyleringen skjer ved hjelp av hexokinase. G6P kan deretter, ved hjelp av enzymet fosfoglukomutase, omdannes til glukose-1-fosfat (G1P). UDP-glukose dannes i en reaksjon mellom glukose-1-fosfat (G1P) og uridin-trifosfat (UTP), og sluttproduktene er UDP-glukose og pyrofosfat (to frie fosfatgrupper). Denne reaksjonen katalyseres av enzymet UDP-glukose pyrofosforylase. I utgangspunktet er denne reaksjonen reversibel, men ettersom pyrofosfatet raskt metaboliseres videre så går reaksjonen hovedsakelig i retning av å produsere UDP-glukose. Ett og ett glukosemolekyl overføres til en voksende glukosekjede på glykogenmolekylet. Enzymet glykogen syntase katalyserer denne reaksjonen og det dannes α-1,4-bindinger mellom glukosemolekylene. UDP-gruppen frigjøres i denne prosessen. Denne prosessen er illustrert i figuren under.
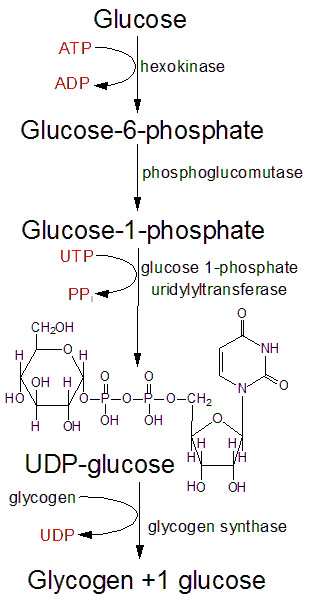
Glykogen syntase kan bare overføre glukosemolekyler til glukosekjeder som allerede består av minst fire glukosemolekyler. Derfor er glykogensyntesen avhengig av et startpunkt, og dette skapes av proteinet glykogenin, som består av to subenheter. Hver av disse subenhetene er i stand til å sørge for at glukosemolekyler fra UDP-glukose fester seg på den andre subenheten, og dette utgjør starten på syntesen av et nytt glykogenmolekyl.
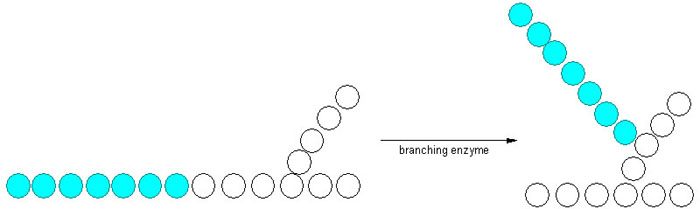
Ettersom glykogenmolekylet lagrer glukosemolekylene i forgreinede kjeder, og glykogen syntase bare kan danne bindinger som legger til glukosemolekyler i en lineær kjede, er glykogensyntesen også avhengig av en siste prosess. Forgreininger dannes etter at glykogen syntase har laget en lang rekke med glukosemolekyler. I prosessen med å lage en forgreining brytes en α-1,4-glykosidbinding, og en gruppe glukosemolekyler fraktes til et annet sted på glykogenmolekylet der det dannes en α-1,6-glykosidbinding. Denne prosessen katalyseres av enzymet amylo-(1,4–1,6)-transglycosylase, også kjent som forgreiningsenzymet.
Glykogennedbrytning
Nedbrytningen av glykogen kalles glykogenolyse og er prosessen der glukosemolekyler spaltes av glykogenmolekylet. Endeproduktet fra glykogenolysen er G6P, og dette molekylet har tre ulike skjebner. Det kan gå inn i glykolysen og dermed frigjøre energi som kan brukes av cellene, det kan defosforyleres til fri glukose og sendes ut i blodet eller det kan gå inn i pentose-fosfatveien og danne NADPH og ribose.
Nedbrytningen av glykogen fører altså til frigjøring av G6P, og denne prosessen skjer i tre steg. Først frigjøres G1P, deretter remodeleres glykogenet for å muliggjøre videre nedbrytning og til slutt omdannes G1P til G6P som kan metaboliseres videre. Disse prosessene krever fire ulike enzymer, ett for frigjøring av G1P, to for remodelering av glykogen og ett for omdanning til G6P.
Frigjøring av G1P (et glukosemolekyl med en fosfatgruppe koblet til karbon nummer 1 fra glykogen skjer ved hjelp av enzymet glykogen fosforylase. Dette enzymet spalter av et glukosemolekyl fra den ikkereduserende enden av glukosekjeden ved å koble på en fosfatgruppe. Denne reaksjonen er avhengig av vitamin B6 som kofaktor.
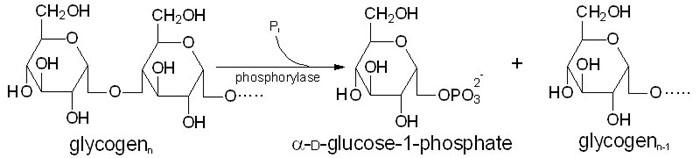
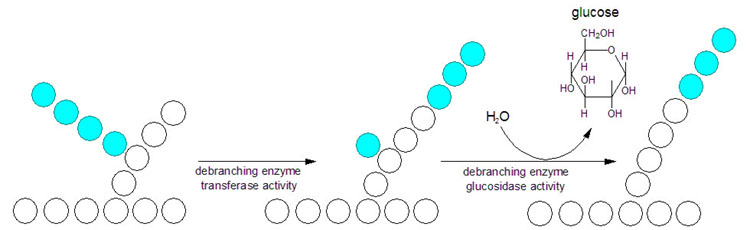
Glykogen fosforylase spalter imidlertid bare α-1,4-bindingene, og aktiviteten stopper opp når det gjenstår fire glukosemolekyler av en kjede. Når vi kommer hit må glykogenmolekylet remodeleres ved hjelp av andre enzymer for at frigjøringen av G1P kan fortsette. Remodeleringen av glykogen skjer ved hjelp av to enzymer. Når en forgrening er redusert til fire glukosemolekyler vil et transferaseenzym overføre de tre ytterste til en annen gren. Det siste glukosemolekylet er bundet til resten av glykogenmolekylet ved en α-1,6-binding, og denne spaltes av hydrolytisk ved hjelp av en α-1,6-glukosidase. Dette frigjør ett fritt glukosemolekyl. Remodeleringen gjør altså at den forgreinede strukturen gjøres om til lineære glukosekjeder, slik at fosforylasen kan fortsette å frigjøre G1P fra enden.
G1P må omdannes til G6P for å kunne metaboliseres videre, og dette skjer ved hjelp av enzymet fosfoglukomutase, som først fester på en fosfatgruppe på karbon nummer 6 og deretter spalter av fosfatgruppen på karbon nummer 1.
Som nevnt kan G6P enten metaboliseres i den aktuelle cellen eller defosforyleres til fri glukose og sendes ut i blodet. Det siste skjer ved hjelp av enzymet glukose-6-fosfatase, som spalter av fosfatgruppen. Dette enzymet finnes i leveren, noe som gjør at leveren kan sende glukosen ut i blodbanen som blodsukker (leveren bruker ikke glukose som energikilde i særlig grad). Muskelvev mangler dette enzymet, så G6P fra glykogennedbrytning i muskel metaboliseres videre til energi i den aktuelle muskelcellen.
Regulering av glykogenmetabolismen
Som vi har sett så er glykogenmolekylet bygget opp slik at både syntese og nedbrytning kan skje raskt og effektivt. Av praktiske grunner så skjer ikke dette samtidig, men hvordan reguleres dette? Glykogensyntesen styres hovedsakelig av glykogen syntase, mens nedbrytningen først og fremst styres av glykogen fosforylase. Regulering av aktiviteten til disse enzymene bestemmer om vi skal lagre eller frigjøre glukosemolekyler fra glykogenet. Muskel- og leverglykogen har ulike bruksområder og reguleres derfor uavhengig av hverandre. Mens muskelglykogenet bare brukes som energikilde lokalt i muskelcellene, brukes leverglykogenet utelukkende for å eksportere glukose til blodet for bruk andre steder.
På et overordnet plan vil glykogensyntese og -nedbrytning aktiveres som følge av tilgang på energimetabolitter og energibehov. Muskelglykogensyntese aktiveres i hvile, mens nedbrytning aktiveres når vi er i aktivitet. Leverglykogenmetabolismen reguleres for å kontrollere blodsukkeret, og glykogensyntesen stimuleres når blodsukkeret stiger og nedbrytning aktiveres når blodsukkeret er lavt. Regulering av enzymaktiviteten skjer både ved fosforyleringskaskader og hormonelt.
I grove trekk vil fosforylering (binding av en fosfatgruppe) av de sentrale enzymene i glykogensyntese og -nedbrytning ha motsatte effekter. Fosforylering av glykogen syntase inaktiverer enzymet, mens fosforylering av glykogen fosforylase aktiverer enzymet. Dette hindrer at syntese og nedbrytning skjer samtidig, og kalles gjensidig eller allosterisk regulering.
Syntese og nedbrytning av glykogen, både i lever og muskel, reguleres også hormonelt. På same måte som med fosforyleringskaskadene så har hormonene også motsatte effekter på syntese og nedbrytning. Adrenalin og glukagon stimulerer nedbrytning ved å aktivere glykogen fosforylase og hemme glykogen syntase. Adrenalin har sin primære effekt på muskelglykogenet, mens glukagon først og fremst stimulerer nedbrytning av leverglykogen. Insulin stimulerer glykogensyntese ved å aktivere glykogen syntase, samtidig som at økte nivåer av glukose inni cellene hemmer nedbrytningen.
Artikkelen er sist oppdatert august 2013